Chemia jajka - część 1

Jaja to powszechny wynalazek Przyrody, wykorzystany przez wszystkie grupy zwierząt. Znoszą je owady, mięczaki, ryby, płazy, gady, ptaki, a nawet prymitywne ssaki (australijskie kolczatki i dziobaki). W artykule ograniczymy się jednak do jaj ptasich jako produktu żywnościowego, a ściślej do jaj kurzych.
Tytułowa "chemia jajka", choć może wydawać się żartem, to fragment działu chemii o nazwie…
…chemia kuchenna
Nazwa jest nieoficjalna, chociaż producenci środków czystości używają tego określenia dla preparatów przeznaczonych do sprzętu kuchennego. Środowisko domowych eksperymentatorów - czytelników działu chemicznego "Młodego Technika" - zaliczy do niej doświadczenia wykonywane przy użyciu wyposażenia kuchennego oraz produktów spożywczych i środków czystości również obecnych w tej części domu. Nie wymaga ona zatem praktycznie żadnego specjalistycznego sprzętu laboratoryjnego oraz profesjonalnych odczynników (choć oczywiście możesz ich również używać). Wbrew pozorom jest to bardzo ciekawy dział, umożliwiający wykonanie wielu doświadczeń, dzięki którym lepiej zrozumiesz nie tylko tajniki przygotowania potraw, ale i prawa przyrody.
Abyś nie wpadł w kompleksy, że nie zajmujesz się "prawdziwą" chemią, wiedz, że profesjonaliści nauk o żywieniu posługują się nazwą kuchnia molekularna. Analizują oni procesy fizykochemiczne zachodzące podczas przygotowywania potraw tak, aby produkty zachowały jak najwięcej wartości odżywczych oraz były smaczne i atrakcyjnie wyglądające. W tym celu łączą zdobycze nauki i techniki z wielowiekową praktyką pokoleń kucharzy oraz analizują stare przepisy. Jak więc widzisz, chemia niejedno ma imię.
Podczas doświadczeń zawsze należy zwracać uwagę na zasady bezpieczeństwa, aby nie zaszkodzić sobie i innym oraz nie spowodować strat materialnych. Choć chemia kuchenna nie niesie zagrożeń porównywalnych z pracą w laboratorium, i tym razem zachowaj rozsądek i rozwagę, jak podczas przygotowania potraw - wtedy eksperymenty będą bezpieczne i przyniosą ci satysfakcję. Kuchnia i laboratorium mają zresztą ze sobą bardzo wiele wspólnego, np. identyczne czynności podczas pracy: gotowanie, sączenie, dekantacja (zlewanie cieczy znad osadu), itp. Niektórzy żartują, że jedyna różnica pomiędzy kuchnią i chemią polega na oblizywaniu łyżki - w tej drugiej dziedzinie nie jest to czynność dozwolona.
Wracając zaś do jajek, pierwszym doświadczeniem będzie…
…analiza skorupki
Skorupka pełni rolę mechanicznej ochronny przed uszkodzeniem cennej zawartości, a jej barwa maskuje jajko przed amatorami tego przysmaku. Oslona nie jest jednak całkowicie szczelna, przeciwnie - liczne pory zapewniają wymianę gazową z otoczeniem. Głównym składnikiem skorupki jest węglan wapnia CaCO3 (ok. 95 % masy), ale zawiera ona również domieszkę innych związków nieorganicznych oraz brązowy pigment o ciekawych właściwościach (w jajach niektórych ptaków występuje również niebieski barwnik).
Zapraszam do eksperymentu, który pozwoli ci najpierw potwierdzić informację o składzie skorupki, a następnie zobaczyć ją w dosłownie innym świetle. Gdy w twojej kuchni będzie przygotowywana potrawa z jajek, umyj detergentem kilka skorupek i usuń z wewnętrznej strony wyściełającą błonę (łatwo zejdzie, gdy potrzesz palcem). Dla twoich celów lepsze będą skorupki o ciemnej barwie, w których zawartość pigmentu jest większa.
Pokrusz skorupki i wsyp kawałki do słoika (zamiast niego możesz oczywiście użyć profesjonalnego sprzętu, np. zlewki). Wlej porcję kwasu solnego o stężeniu 10-20% lub zwykłego spożywczego octu (10% roztwór kwasu octowego). Od razu zauważysz oznaki zachodzącej rekcji: wydzielają się pęcherzyki gazu. Pamiętaj, aby skorupki nie były zbyt drobno pokruszone, inaczej reakcja zajdzie gwałtownie i zawartość słoika silnie się spieni (ale doświadczenie i tak przeprowadź na tacy). Ponieważ wydzielanie bezwonnego gazu przez minerały potraktowane kwasem stanowi dowód obecności węglanów, obserwacja przebiegu próby potwierdza podany wcześniej skład skorupki (1). Powstający dwutlenek węgla spowoduje zmętnienie kropli wody wapiennej (nasycony rozwór wodorotlenku wapnia) umieszczonej na końcu bagietki, którą wprowadzisz do słoika. Również zapalona zapałka zgaśnie w naczyniu. Kropla roztworu po reakcji wywoła zaś ceglastoczerwone zabarwienie płomienia palnika gazowego, co jednoznacznie identyfikuje wapń.
- pierwszy etap doświadczenia potwierdza,
że w jej skład wchodzi węglan wapnia
Świecąca skorupka
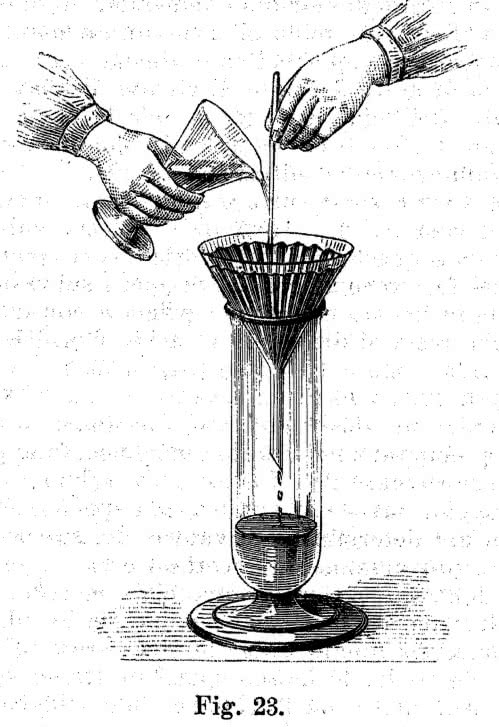
Po zakończeniu reakcji odsącz niepotrzebne już pozostałości. I tym razem wystarczy kuchenny lejek wyłożony papierowym ręcznikiem (2). Ponieważ interesuje cię przesącz, lejek umieść w nowym, czystym słoiku. Cieczy nie wlewaj bezpośrednio na sączek, ponieważ może się on przerwać i trzeba będzie zacząć sączenie od nowa. Najlepiej nalewaj roztwór po bagietce szklanej lub plastikowej słomce przytkniętej do sączka (3). Przesącz zawiera resztki kwasu, sól wapnia oraz barwnik uwolniony ze skorupki.
pozwoli uniknąć uszkodzenia sączka (ilustracja z podręcznika
analizy chemicznej z 1895 roku)
Kolejnym odczynnikiem, który będzie ci potrzebny, jest octan etylu, ester o przyjemnym zapachu stosowany jako rozpuszczalnik. Jeżeli nie masz tego związku, poszukaj bezacetonowego zmywcza lakieru do paznokci. W jego składzie znajduje się m.in. potrzebny ci związek. Zmywacz zwykle jest zabarwiony, co przeszkodziłoby w zauważeniu efektów próby, musisz więc usunąć barwnik. Wlej do słoika kilka cm3 zmywacza, dodaj szczyptę węgla aktywnego, np. sproszkowanego węgla drzewnego używanego do grillowania. Zamieszaj całość, pozwól, aby węgiel opadł na dno, a następnie przesącz (jak wyżej) ciecz do nowego naczynia (4).
Wlej odbarwiony zmywacz do słoika z rozpuszczonymi skorupkami, zakręć zakrętkę, dobrze wytrząśnij i odstaw, aby ciecze się rozwarstwiły (zmywacz znajduje się na wierzchu). Włącz tester do banknotów i oświetl zawartość naczynia. Górna warstwa przybierze czerwonawy kolor (5).
Zgodnie z zapowiedzią zobaczyłeś skorupkę w innym, nadfioletowym, świetle. Efekt jest bez wątpienia niespodziewany, ale zapewne interesuje cię wytłumaczenie zjawiska (o które przecież mogą zapytać inni, gdy pokażesz im eksperyment).
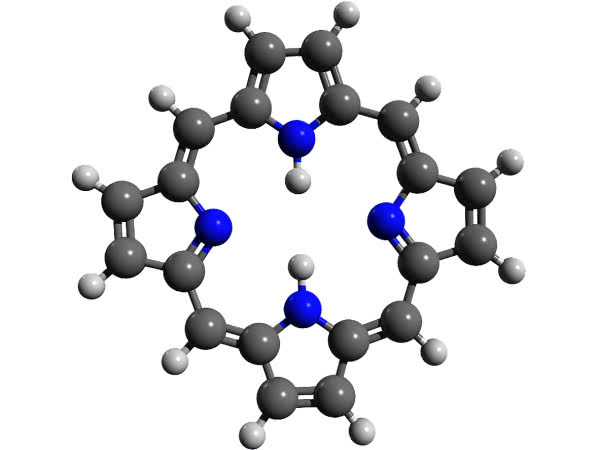
W reakcji z kwasem doszło do uwolnienia brązowego barwnika ze skorupki. Jest nim pochodna porfiryny, związku szeroko rozpowszechnionego w przyrodzie ożywionej (6). Układ pierścieni porfiryny znajduje się w tak ważnych substancjach jak hemoglobina i chlorofil, a także jako składnik wielu enzymów oraz witaminy B12. W świetle nadfioletowym porfiryny wykazują fluorescencję, co zaobserwowałeś jako czerwonawe świecenie warstwy rozpuszczalnika organicznego (jej pochodne lepiej rozpuszczają się w cieczy organicznej niż w wodzie - zostały z niej wyekstrahowane). Do odbarwienia zmywacza lakieru wykorzystałeś adsorpcyjne właściwości węgla aktywnego, czyli wiązanie barwnika na powierzchni cząstek węgla.
Kolorowe skorupki
Barwienie jaj praktykowane jest od dawna w wielu kulturach, także i u nas. Chemik bez trudu mógłby uzyskać skorupkę w praktycznie dowolnym kolorze, ale ponieważ jajka są przeznaczone do konsumpcji, należy używać tylko takich barwników dopuszczonych do kontaktu z żywnością (pigmenty przenikają przez pory skorupki). Możesz co prawda kupić "farbki do jaj", ale znacznie większą satysfakcję sprawi ci samodzielny dobór barwników. W przeciwieństwie do poprzedniego eksperymentu, jajka o jasnej skorupce lepiej nadają się do twoich celów. Przed barwieniem umyj je dokładnie i ewentualnie zanurz na kilkanaście sekund w occie, co pozwoli otworzyć pory w skorupce, w które łatwiej wnikną barwniki. Octu dodaj również do kąpieli barwiącej, aby uzyskać intensywniejsze kolory (możesz go zastąpić kwaskiem cytrynowym). Intensywność koloru zależy również od długości przebywania jajek w kąpieli. Barwić możesz zarówno jajka surowe (ugotują się na twardo w wywarze), jak i już ugotowane (7). Pamiętaj, aby pracować ostrożnie i nie zabrudzić kuchni.
Oto zestaw najczęściej stosowanych barwników naturalnych:
- łupiny cebuli pozwolą uzyskać kolor jasnobrązowy, herbata zaś - ciemnobrązowy
- kurkuma lub curry dadzą złociste zabarwienie
- buraki zabarwią jajka na kolor różowoczerwony (im dłużej jajka przebywają w kąpieli, tym barwa jest ciemniejsza)
- w wywarze z czerwonej kapusty skorupki staną się niebieskie
- zielony kolor uzyskasz przy pomocy szpinaku, świeżej trawy lub młodych pokrzyw
- łupiny orzecha włoskiego lub kora dębu zabarwią skorupki na prawie czarny kolor
- marchewka to z kolei barwa pomarańczowa
Czas gotowania wynosi zwykle kilkakilkanaście minut, ale musisz go dobrać eksperymentalnie. Paleta naturalnych barwników jest oczywiście znacznie większa, zatem przed tobą duże pole do popisu. Przetarcie olejem nada połysk kolorowym jajkom (8).
Skorupki nie do kosza!
Skorupki jajek zwykle lądują w koszu na śmieci (wrzuć je do bioodpadów, przyroda od milionów lat umie sobie z nimi radzić), możesz je jednak wykorzystać na kilka sposobów, o których wiedziały już nasze prababcie. Skorupki to źródło dobrze przyswajalnego wapnia, należy je tylko najpierw odpowiednio przygotować: starannie umyć jajka przed rozbiciem, usunąć błonę ze skorupki, osuszyć je i wyprażyć w piekarniku lub na patelni. Po zmieleniu w młynku lub utarciu w moździerzu na proszek, użyj ich jako dodatku do zup, wypieków czy jogurtów. Skorupka przeciętnego jajka waży około 5 gramów, co zapewnia dwukrotne pokrycie dziennego zapotrzebowania na wapń (proszek zawiera także inne mikroelementy). W tym samym celu skorupki dodaje się do paszy dla drobiu.
Pokruszone skorupki możesz kompostować lub zastosować jako nawóz do odkwaszania gleby w swoim ogrodzie, a także podłoże roślin doniczkowych. Woda, w której przez kilka dni moczyły się skorupki, to również doskonała odżywka dla roślin.
Jak zatem widzisz, niepozorna skorupka jajka jest ciekawym obiektem doświadczeń, a także surowcem do wielu zastosowań. Prawdziwe jednak bogactwo kryje się wewnątrz, ale o tym za miesiąc.
Krzysztof Orliński